|
  Imprimer Imprimer
Fiche méthode
n°1 : Modalités des épreuves de Physique-Chimie
au Baccalauréat série S
Epreuve écrite : durée
: 3 h 30 notée sur 16 points.
Epreuve expérimentale : 1 heure notée sur
4 points.
Epreuve
écrite :
Pour les candidats n'ayant
pas choisi la Physique-Chimie comme spécialité:
coefficient 6.
Pour les candidats ayant choisi
la Physique-Chimie comme spécialité : coefficient
8.
|
|
|
enseignement
obligatoire |
enseignement
obligatoire
+
enseignement de spécialité |
|
Durée épreuve
écrite |
3 h 30 |
|
coefficient |
|
6 |
8 |
|
total des points ecrit : 16
points |
exercice de spécialité
/ 4 |
|
tronc
commun / 12 |
Epreuve
expérimentale :
Notée sur 4 points
Durée de l'épreuve : 1 heure
Déroulement :
Le candidat arrive à
un poste équipé avec le matériel qu'il a
utilisé durant son année scolaire ; il trouve sur
la paillasse l'énoncé du sujet (fiche 3) et la
feuille sur laquelle il devra consigner ses réponses (fiche
7).
Le professeur évaluateur,
muni du barème d'évaluation pendant la séance
, évalue au plus quatre élèves simultanément.
Le professeur suit le déroulement de la manipulation pour
chaque candidat. Il intervient si l'un d'entre eux rencontre
un problème technique (panne) ou théorique afin
de lui permettre de réaliser la partie expérimentale
attendue ; il intervient également si le candidat semble
en échec ou met en danger sa sécurité. Ces
interventions sont prise en compte dans l'évaluation.
- La fiche 3 s'adresse au candidat.
Elle indique le but de la manipulation
ainsi que toutes les tâches à effectuer. Elle avertit
le candidat quand celui-ci doit se reporter à la fiche
7. Elle lui signale les moments clés où il doit
appeler l'évaluateur pour faire vérifier son travail.
Le but étant ici d'évaluer des savoir-faire expérimentaux
et la réflexion liée à la manipulation proposée,
les formules et informations nécessaires sont généralement
rappelées.
- La fiche 7 est la feuille
que l'élève rendra à la fin de l'épreuve.
Un élève ayant
choisi l'enseignement de spécialité Physique-Chimie
peut être évaluer soit sur un sujet de tronc commun,
soit sur un sujet de spécialité.
Exemple simplifiée
de fiche 3

  Imprimer Imprimer
Fiche méthode
n°2 : Bilan de masse et d'énergie d'une réaction
nucléaire
|
Méthode pour effectuer un bilan
de masse et d'énergie :
- On calcule le défaut
de masse Dm
= mréactifs - mproduits
- Si Dm =
mréactifs - mproduits > 0 alors il y a libération
d'énergie.
- On calcule l'énergie libérée en appliquant
la relation d'équivalence E = Dmc2
On utilisera les conversions
d'unité les plus appropriées afin de réduire
les applications numériques.

Attention, dans le cas de l'utilisation
des énergies de liaison on calcule l'énergie libérée
en effectuant le calcul suivant
E = Eliaison
d'une libération
d'énergie - Eliaison
d'un apport d'énergie
Car :

Voir exemple de la fission |
1. Exemple
pour la radioactivité : Cas d'une désintégration
a.
La réaction étudiée
est 
Données : mRa =
225,9771 u mRn = 221,9704 u mHe = 4,0015
u
1 u = 931,5 MeV/c2
- Calcul de Dm = mréactifs - mproduits
= 225,9771 - (221,9704
+ 4,0015) = 5,200 x 10-3 u
- La conversion appropriée est 1 u = 931,5 MeV/c2
- On applique la relation d'équivalence E = Dmc2 alors E = 5,200
x 10-3 x 931,5 = 4,84 MeV
2. Exemple
pour la fission.
La réaction étudiée
est 
Données : El (235U)
= 1784 MeV El (94Sr) = 808 MeV El (140Xe)
= 1161 MeV
Calcul direct de l'énergie
libérée :
E = El (libération d'énergie)
- El (apport d'énergie)
E = [El (94Sr) + El (140Xe)
]- El (235U) = (808 + 1161) - 1784 = 185 MeV
3. Exemple
pour la fusion.
La réaction étudiée
est 
Données :
Réactifs m3H
= 5,0074 x 10-27 kg m2H = 3,3437
x 10-27 kg
Produits m4He = 6,6447 x 10-27kg mn
= 1,6750 x 10-27kg
- Calcul de Dm
Dm
= mréactifs - mproduits
Dm =
(5,0074 x 10-27+ 3,3437 x 10-27) - (6,6447
x 10-27+ 1,6750 x 10-27)
Dm =
3,1400 x 10-29 kg
- On applique la relation d'équivalence
E = Dmc2
E = 3,1400 x 10-29 x (3,0 x 108)2
= 2,8260 x 10-12 J
E =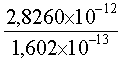 =
17,6 MeV =
17,6 MeV
  Imprimer Imprimer
Fiche méthode
n° 3 : Détermination de Qr, eq à
partir de mesures conductimétriques
1. Principe.
- On introduit dans un ballon
un volume V d'une solution acide de concentration c.
- On place dans la solution, la cellule du conductimètre
préalablement calibré avec une solution étalon.
- On lit la valeur de la conductivité s.
2. Détermination de
Qr, eq.
Soit l'équation de la
réaction : 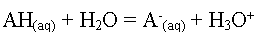
Données : c,
l (H3O+) et l (A-)
Mesure : s ou G
Remarque : si on mesure G alors 
- On écrit l'expression
de la conductivité 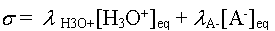
- La réaction étant équimolaire, on a [H3O+]
= [A-]
- On déduit que 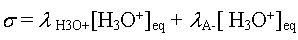 et
et 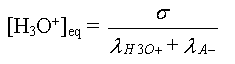
- On écrit la conservation de la matière :
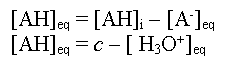
- On en déduit l'expression
de Qr, eq en fonction de [H3O+]

- A partir de la valeur de
s trouvée expérimentalement, on
trouve la valeur de
avec l'expression 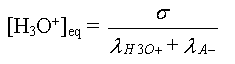
- On en déduit la valeur de Qr, eq.
  Imprimer Imprimer
Fiche méthode
n° 4 : Détermination de la constante d'équilibre
associée à une réaction acido-basique.
1. Autoprotolyse
de l'eau.
2 H2O = H3O+(aq) +
HO- (aq)
Ke = [H3O+]
x [HO-]
K = [H3O+] x [HO-]
K = Ke
2. Réaction
d'un acide avec l'eau.
AH(aq)
+ H2O = A-(aq)
+ H3O+
K = 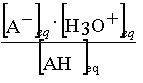
KA = 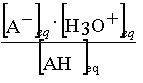
K = KA
3. Réaction
d'une base avec l'eau.
A-(aq) +
H2O = AH(aq) + HO-(aq)
K = 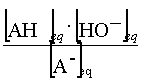
Reprenons l'expression de la
constante d'acidité associée à la réaction
AH(aq) + H2O = A-(aq) +
H3O+
KA = 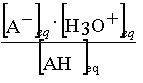

Astuce : Multiplier par [H3O+]eq
le numérateur et le dénominateur de l'expression
de K
K =  
On retrouve l'expression de
Ke = [H3O+] x [HO-]au numérateur
et 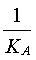

4. Réaction
d'un acide avec une base.
Soit la réaction suivante
:
CH3COOH(aq) + NH3 (aq)
= CH3COO-(aq)
+ NH4+(aq)
Dans un premier temps on écrit
:
Couple 1 : CH3COOH /
CH3COO-
Equation associée à
la reaction CH3COOH avec l'eau : CH3COOH(aq)
+ H2O = CH3COO-(aq) + H3O+(aq)
Constante d'acidité
associée : KA1 = 
Dans un deuxième temps,
on écrit :
Couple 2 : NH4+
/ NH3
Equation associée à
la reaction NH4+ avec l'eau : NH4+(aq) +
H2O = NH3 (aq) + H3O+(aq)
Constante d'acidité
associée : KA2 = 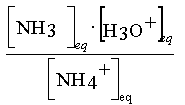
Dans un troisième temps,
on écrit la constante d'équilibre associée
à la réaction :
CH3COOH(aq) + NH3 (aq)
= CH3COO-(aq) + NH4+(aq)
K = 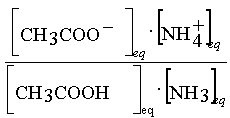

Astuce : Multiplier par [H3O+]eq
le numérateur et le dénominateur de l'expression
de K
K = 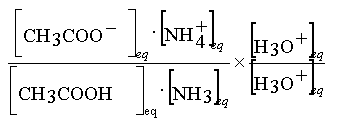
On retrouve l'expression de KA1 et de 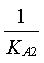
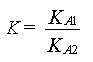
Fiche méthode
n° 5 : La méthode d'Euler

|