|
  Imprimer Imprimer
EPISODE IV : UNION DES HUMAINS,
DES KLINGONS ET DES ROMULIENS POUR SAUVER LA GALAXIE
Dans l'épisode précédent,
vous avez pris conscience du danger du Borg-H qui transforme
tous les êtres en Borg. Les Klingons, d'anciens ennemis
et les Romuliens, de nouveaux ennemis, eux aussi ont pris conscience
que l'ensemble de la Galaxie était menacée par
les Borgs. Ils ont proposés à la Fédération,
deux techniques différentes pour mesurer la réactivité
du Borg-H en milieu aqueux. Connaître sa réactivité,
revient à savoir comment mieux le détruire.
Le Borg-H est un acide qui a pour base conjuguée le Borg-.
La réaction entre la molécule de Borg-H et l'eau
modélise la transformation étudiée.
Les parties 1 et 2 ont en commun
le calcul de l'avancement final de cette réaction par
les deux techniques, Klingon et Romulienne dont la précision
sera discutée dans la partie 3.
1. Méthode
Klingon : Etude de la transformation chimique par une mesure
du pH.

1.1. Déterminer, à
l'équilibre, la concentration [H3O+]éq,
en ions oxonium dans la solution S préparée.
1.2. L'acide Borg-H réagit avec l'eau. Ecrire l'équation
de la réaction modélisant cette transformation.
1.3. Déterminer l'avancement final xf de
la réaction.
1.4. Déterminer l'avancement maximal xmax
de la réaction.
1.5. Déterminer le taux d'avancement final t de la réaction.
La transformation étudiée est-elle totale ?
2. Méthode
Romulienne : Détermination de la constante d'équilibre
de la réaction par conductimétrie.

2.1. Dans les conditions de l'expérience, on peut négliger
la contribution d'un des ions à la conductivité
de la solution Lequel ? Quelle devient alors l'expression de
la conductivité de la solution ?
2.2. Exprimer l'avancement final xf
de la réaction entre
l'acide Borg-H et l'eau, en fonction de s, des conductivités
molaires ioniques utiles et du volume VS.
2.3. En déduire la valeur de xf.
2.4. Calculer les concentrations molaires à l'équilibre
des espèces Borg-H, Borg- et H3O+.
2.5. Donner l'expression de la constante d'équilibre K
associée à l'équation de la réaction
entre l'acide Borg-H et l'eau, puis la calculer.
3. Comparaison
de la précision des techniques Klingon et Romulienne :
pH-métrie et conductimétrie.
Le pH-mètre utilisé
donne une valeur de pH précise à 0,1 unité
près, et le conductimètre donne une valeur de conductivité
précise à 1 mS.m-1.
La valeur du pH est donc comprise
entre 2,8 et 3,0 et celle de la conductivité entre 43
mS.m-1 et 45 mS.m-1.
Le tableau ci-dessous indique les valeurs de l'avancement final
de la réaction calculées pour ces différentes
valeurs de pH et de conductivité.

Conclure brièvement
sur la précision des deux techniques, sans procéder
à un calcul d'erreur relative.
Laquelle de ces deux techniques proposez-vous d'utiliser pour
sauver la Galaxie ?
  Imprimer Imprimer
Correction de l'extrait
de l'examen de janvier 2005 "Les Borgs"
Episode IV
1.1. A partir de la définition
du pH, on a [H3O+] = 10(-pH) = 10(-2,9) = 1,26 x 10-3mol.L-1
0,5 point
1.2. Borg-H + H2O
= H3O++ Borg- 0,25 point
1.3. xf = [H3O+]eq
x V = 1,26 x 10-3x 0,500 = 6,30 x 10-4
mol. 0,5 point
1.4. xmax = cS V = 5,55
x 10-3 x 0,500 = 2,78 x 10-3 mol. 0,5 point
1.5. 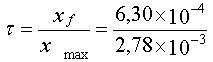 =
0,23 0,5 point =
0,23 0,5 point
2.1. On peut négliger les ions hydroxyde HO- qui sont
en très petite quantité.
L'expression de la conductivité devient alors s
= l H3O+.[H3O+]
+ l Borg-.[Borg-] 0,25 point
2.2. La réaction étant
équimolaire, on a [H3O+] = [Borg-] alors s
= l H3O+].[H3O+] + l Borg-.[H3O+]
= [H3O+](l
H3O+ + l Borg-.)
donc  ;
l'avancement final est égal à ;
l'avancement final est égal à
xf = 0,5
point 0,5
point
2.3. xf =  =
5,7 x 10-4 mol. 0,5 point =
5,7 x 10-4 mol. 0,5 point
2.4. [H3O+]eq = = 1,14 x 10-3 mol.L-1
= 1,14 x 10-3 mol.L-1
[Borg-]eq = [H3O+]eq = 1,14 x 10-3mol.L-1
et [Borg-H]eq = cS - [Borg-]eq = 5,55 x 10-3- 1,14 x 10-3
= 4,41 x 10-3mol.L-1. 0,75 point
2.5.  = 2,95 x 10-40,5 point
= 2,95 x 10-40,5 point
3. Par la technique pHmétrique,
pour un écart de 0,2 unité pH, on a un écart
important entre les avancements finaux, tandis que pour un écart
de 2 mS.m-1 par conductimétrie, on a une différence
faible entre les deux valeurs d'avancements finaux.
0,25 point
Il faut donc utiliser la technique Romulienne pour sauver la
galaxie.
|