|
  Imprimer Imprimer
Transformations
lentes et rapides
I. Rappels sur les couples
oxydant/réducteur et sur l'écriture des réactions
d'oxydoréduction.
1. Un exemple
de réaction d'oxydoréduction : la réaction
entre l'ion peroxodisulfate avec l'ion iodure

Expérience :
o Mettre dans un bécher,
50 mL de la solution aqueuse d'iodure de potassium. CKI
= 2,5 x 10-1 mol.L-1
o Versez 50 mL de la solution aqueuse de peroxodisulfate de sodium.
CNa2S2O8 = 5,0 x 10-3 mol.L-1
o Agiter.
L'équation associée
à cette transformation est : 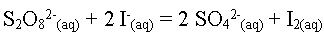

Question-réponse :
- Quels sont les deux couples
mis en jeu ? (oxydant/réducteur)
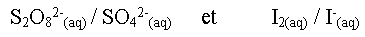
- Ecrire les demi-équations correspondantes.
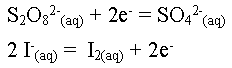
- Retrouver l'équation de la transformation chimique.
On multiplie par deux la première demi-équation
afin le nombre de mole d'électrons soit le même.
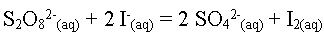
- La réaction est-elle
lente ou rapide ?
La réaction est lente car la couleur ne change pas pendant
la durée de la mesure par l'œil que l'on peut estimer
à 1 seconde environ.
- A quel produit est dû
l'apparition de la couleur brune ?
La couleur brune est due à l'apparition du diiode.
2. Définitions
- un réducteur est une
espèce chimique susceptible de céder un ou plusieurs
électrons.
Exemple : H2O2 dans la transformation précédente.
- Un oxydant est une espèce
chimique susceptible de capter un ou plusieurs électrons.
Exemple : l'ion peroxodisulfate 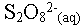 dans la transformation précédente.
dans la transformation précédente.
Il ne faut jamais dissocier
l'oxydant, du réducteur qui lui est mis en présence.
En effet le peroxyde d'hydrogène H2O2
se comporte soit comme réducteur, soit comme un oxydant.
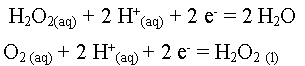
- une demi-équation
d'oxydoréduction s'écrit : oxydant + n e-
= réducteur
- une réaction d'oxydoréduction est une transformation
chimique mettant en jeu un transfert d'électrons entre
un réducteur (qui cède des électrons) et
un oxydant (qui capte des électrons).
II. Qu'est-ce qu'une transformation lente ?
1. La qualification
lente ou rapide dépend de la technique de mesure utilisée.
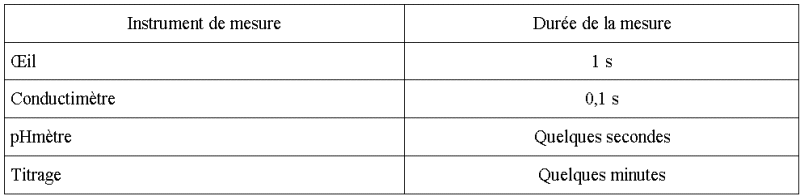
Si la grandeur mesurée
ne change pas de façon significative pendant la durée
de la mesure, on qualifie la réaction de lente.
2. Exemples
de transformations chimiques observées à l'œil.

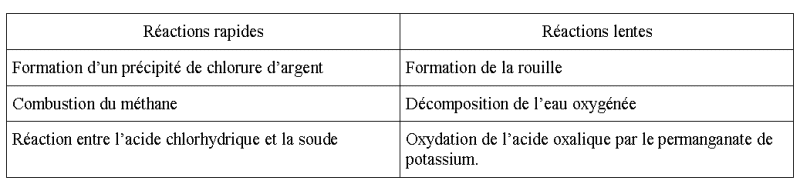
Question-réponse :
Ranger dans la colonne correspondante
les transformations chimiques suivantes :
- Formation de la rouille.
- Formation d'un précipité de chlorure d'argent.
- Oxydation de l'acide oxalique par le permanganate de potassium.
- Décomposition de l'eau oxygénée.
- Combustion du méthane.
- Réaction entre l'acide chlorhydrique et la soude.
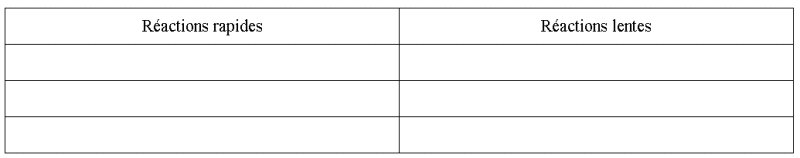
Réponses :
III. Influence des facteurs cinétiques sur la vitesse
de réaction.
La mise en évidence
expérimentale de l'influence des facteurs cinétiques
aura été réalisée en TP.
1. La température
est un facteur cinétique.
- une transformation chimique
est d'autant plus rapide que la température des réactifs
est élevée.
- Illustrations dans la vie courante :
cuisson à l'autocuiseur. (page 32 figure 16)
conservation des aliments par le froid. (page 31 figure 15)
- Applications au laboratoire
:
chauffage pour accélérer
la réaction.
trempe (bain d'eau froide) pour stopper la réaction.
2. La concentration
des réactifs et un facteur cinétique.
- Une transformation chimique
est d'autant plus rapide que la concentration des réactifs
est grande (en général).
- Applications au laboratoire
:
la dilution : en diminuant
la concentration des réactifs, on peut ralentir ou stopper
une réaction.
Remarque : si l'on verse de
l'eau froide dans un milieu réactionnel, on fait intervenir
les deux facteurs cinétiques (trempe + dilution).
  Imprimer Imprimer
Suivi temporel d'une
transformation chimique
En TP, un suivi par
titrage sera réalisé, cliquer sur TP
I. Etude cinétique
d'une transformation : suivi par un capteur de pression.
1. Equation
associée à la réaction entre le magnésium
et l'acide chlorhydrique.
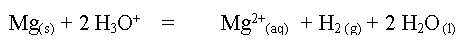
2. Objectifs.
- suivre l'avancement x(t)
de la réaction à l'aide d'un capteur de pression.
- établir la relation entre l'avancement x(t)
de la réaction et la surpression Dp dans le ballon.
- déterminer :
o l'avancement maximal xmax de la réaction.
o La valeur du temps demi-réaction.
o La valeur de la vitesse volumique à une date donnée.
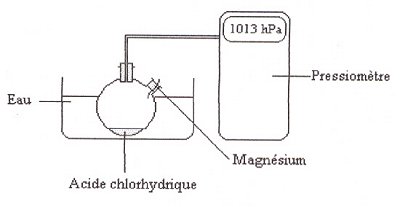
3. Description
de l'expérience.
On introduit dans un ballon
bicol de 250 mL relié à un pressiomètre
:
o 50,0 mL d'acide chlorhydrique
de concentration molaire c = 5,0 x 10 mol.L-1
o 0,020 g Magnésium (ruban) bien décapé.
(le morceau de magnésium est maintenu par le bouchon de
telle manière qu'il puisse tomber au fond du ballon après
une petite secousse.
M (Mg) = 24,3 g.mol-1
On relève la valeur
de la pression toutes les 30 secondes pendant 10 min.

4. Description
de l'évolution du système au cours de la transformation

Question-réponse
Compléter le tableau
descriptif de l'évolution du système au cours de
la transformation :
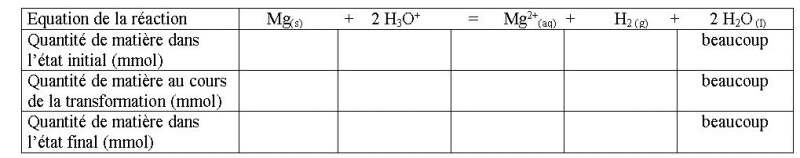
Réponse :
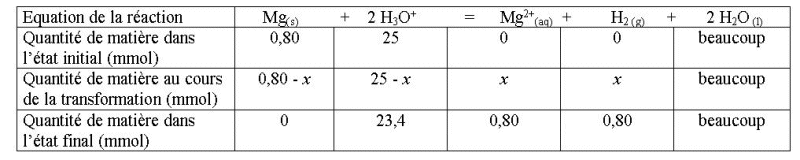
Voir chapitre 6.1 plus loin,
pour le détail des calculs.
5. Etablissement
de la relation entre x(t) et Dp.
- Le pressiomètre mesure
la pression dans le ballon au cours de la transformation :
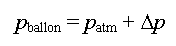
- dans les conditions initiales
: 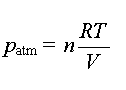
n : quantité de matière des espèces
(O2 et N2) présentes dans l'air.
R : constante des gaz parfaits R = 8,31 S.I.
T : température (K)
V : volume (m3)
- au cours de la transformation
:
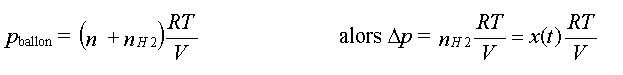
Relation entre la différence
maximale de pression et l'avancement maximal vancement maximal
: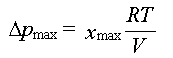 On
obtient la relation : On
obtient la relation : 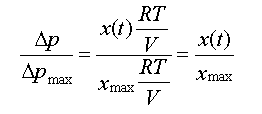
Alors 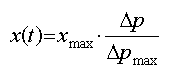
6. Définitions
et détermination des grandeurs caractéristiques
de la réaction.
6.1. Avancement maximal (rappel
de cours).
- Dans une réaction
chimique, le réactif dont la disparition provoque l'arrêt
de la transformation est le réactif limitant.
- Dans l'état d'avancement maximal, le réactif
limitant a totalement réagi.
- L'avancement maximal est égal à la quantité
totale du réactif limitant.
- Détermination de xmax.

Le réactif limitant
est le magnésium.

Question-réponse.
Déterminer x(t)
pour les différentes dates et tracer le graphe x=
f(t)
Compléter le tableau
suivant :
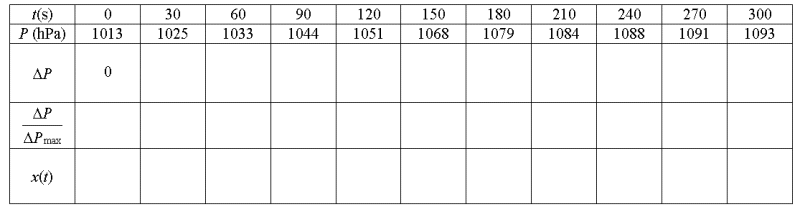
Réponse :

Tracer le graphe x= f(t)

Réponse :
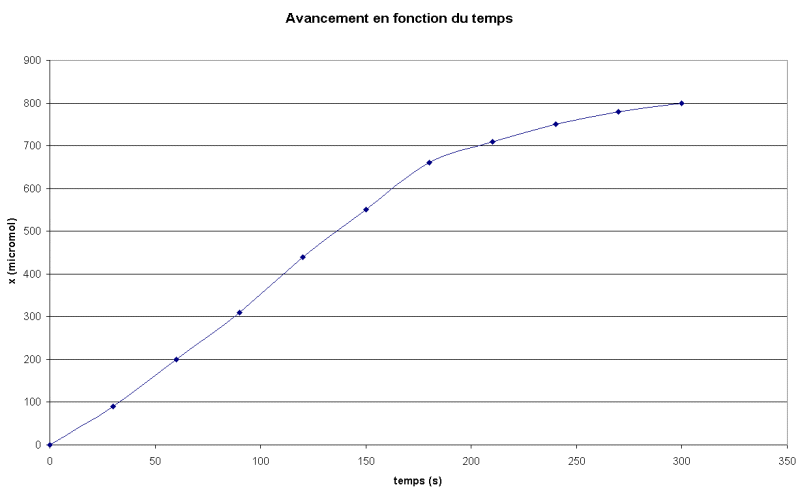
6.2. Temps de demi-réaction
t1/2
a- Définition :
Le temps de demi-réaction,
noté t1/2, est la durée au bout de laquelle
l'avancement x de la réaction est égale à
la moitié sa valeur maximale.
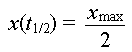
b- Détermination graphique
du temps de demi-réaction.
- On calcule 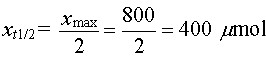
- On détermine sur la graphe la date correspondant à
cette valeur.
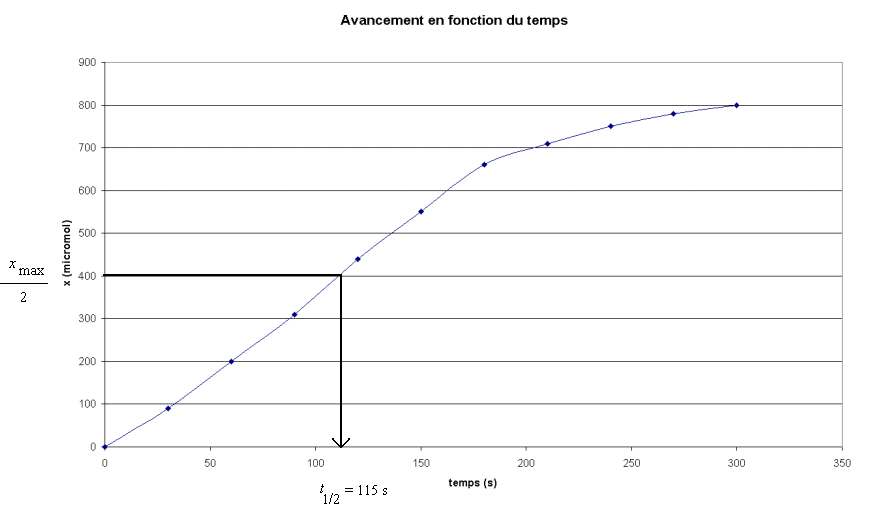
- Le temps de demi-réaction
de cette transformation est t1/2 = 115 s.
6.3. Vitesse volumique de réaction.
a- Définition.
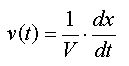
v(t) : vitesse volumique de
réaction (mol.L-1.s-1) D'autres
unités peuvent être utilisées dans les exercices
V : volume de la solution (L)
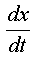 : dérivée de l'avancement de la réaction
par rapport au temps. (mol.s-1)
: dérivée de l'avancement de la réaction
par rapport au temps. (mol.s-1)
Coefficient directeur de la tangente à la courbe à
la date t
b- Détermination graphique
d'une vitesse volumique de réaction (limite externe du
programme de TS)

La vitesse volumique de réaction
à la date t est égale au quotient du coefficient
directeur de la tangente à la courbe à la date
t par le volume de la solution.
Dans notre cas à t
= 180 s 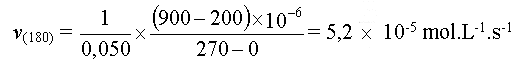
Rappel : V = 50 mL = 0,050 L
c- Variation de la vitesse
de réaction.

Question-réponse
- Comment varie la vitesse
au cours du temps lors de cette transformation chimique ?
Au fur et à mesure que
la transformation se déroule, le coefficient directeur
des différentes tangentes aux différentes dates,
diminue. Alors la vitesse diminue au cours du temps.

- Pourquoi diminue-t-elle ?
La concentration des réactifs
diminue au cours du temps.
La concentration des réactifs étant un facteur
cinétique, la vitesse diminue quand la concentration des
réactifs diminue.
- Dans quels cas, la vitesse
de réaction peut-elle augmenter au cours du temps ?
o Si la réaction est
très exothermique (c'est à dire qu'elle dégage
de la chaleur)
La température étant un facteur cinétique,
la vitesse augmente si la température augmente.
o Si l'un des produits est un catalyseur de sa propre réaction
de formation.
  Imprimer Imprimer
Une nouvelle
technique d'analyse : la spectrophotométrie
I. La spectrophotomérie
- Présentation powerpoint interactive (question-réponse),
Cliquer sur  (pour l'enregistrer :
click droit puis enregistrer la cible sous) (pour l'enregistrer :
click droit puis enregistrer la cible sous)
- Présentation au format html non interactive,
cliquer sur 
- Présentation au format
PDF non interactive, cliquer sur 
- Présentation au format word non interactive, cliquer
sur 
II. Suivi de la cinétique
d'une transformation chimique par spectrophotométrie.
(Voir TP) Cliquer sur TP
  Imprimer Imprimer
Interprétation
au niveau microscopique de la réactions chimique en terme
de chocs efficaces
I. Le mouvement brownien.
Le mouvement brownien est le
nom donné aux mouvements aléatoires de petites
particules solides sous l'impact des molécules d'un fluide
(liquide ou gaz).
Il a été découvert par le botaniste écossais
ROBERT BROWN en 1827, en observant des grains de pollen en suspension
dans l'eau.
Exemple de trajectoires aléatoires
obtenu à partir d'une feuille de calcul Excel, réalisée
par ERIC BUTZ de l'IUFM de la Réunion.
http://www.reunion.iufm.fr/recherche/irem/Fiches/Butz15.htm
II. Une modélisation
microscopique rendant compte des observations macroscopiques.
Cette activité peut
être réalisée en cours ou en TP.
1. La réaction
étudiée :
B + R = V + J
On étudiera aujourd'hui
que les situations impliquant la réaction dans le sens
direct (de la gauche vers la droite).
2. Le modèle
proposé :
Les entités (molécules,
atomes, ions) sont représentées par des boules
de couleurs différentes.
(Ces boules peuvent être
acheté en quincaillerie ou simplement fabriquées
en roulant des bouts de papiers colorés à la main)
Les réactifs sont les
boules rouges (R) et bleues (B).
Les produits sont les boules vertes (V) et Jaunes (J).
Le solvant (par ex. l'eau) est représentée par
des boules blanches.
A chaque tirage une rencontre
entre deux entités a lieu.
Chaque tirage représente une unité de temps (par
ex. une seconde)
3. La probabilité
de rencontre dépend de
:
- La quantité d'entités
présente.
- La concentration (dilution)
- La température (chocs efficaces ou non)

4. La
règle du jeu :
- Verse dans un bécher
20 boules rouges et 20 boules bleues.
- Tire au hasard 2 boules :
1. Si les boules tirées
sont rouge et bleue :
a. tire à pile ou face
avec une pièce de monnaie :
i. Si c'est pile (par ex.)
considère que le choc est efficace, alors retire les deux
boules rouge et bleue et remplace-les par une boule verte et
une boule jaune.
ii. Si c'est face considère que le choc n'est pas efficace,
alors remet les boules rouge et bleue dans le bécher.
2. Si les boules tirées
ne sont pas rouge et bleue, remet les dans le becher.
- Effectue environ 100 tirages
et consigne tes résultats dans un tableau à chaque
tirage, la quantité de boules vertes ou jaunes présentes
dans le bécher. (on peut également noté
la quantité de boules rouges ou bleues restante).
5. Les différents
cas étudiés :
- Situation de référence
(température ambiante sans dilution) :
20 R + 20 B avec une probabilité
de choc efficace de ½ (lancé d'une pièce
de monnaie).
- Augmentation de la température
(augmentation de la probabilité de chocs efficaces) :
20 R + 20 B avec une probabilité
de choc efficace = 1 (pas de lancé de pièce de
monnaie) :
- Diminution de la concentration
par dilution :
20 R + 20 B + 20 Blanches avec
une probabilité de choc efficace de ½ (lancé
d'une pièce de monnaie).
6. Question
:
Représente pour les
3 cas étudié les graphes V = f(t)
V étant le nombre de boules vertes formées.
Détermine la valeur du temps de demi-réaction t1/2
7. Résultats
:
1. Situation de référence (température ambiante
sans dilution).
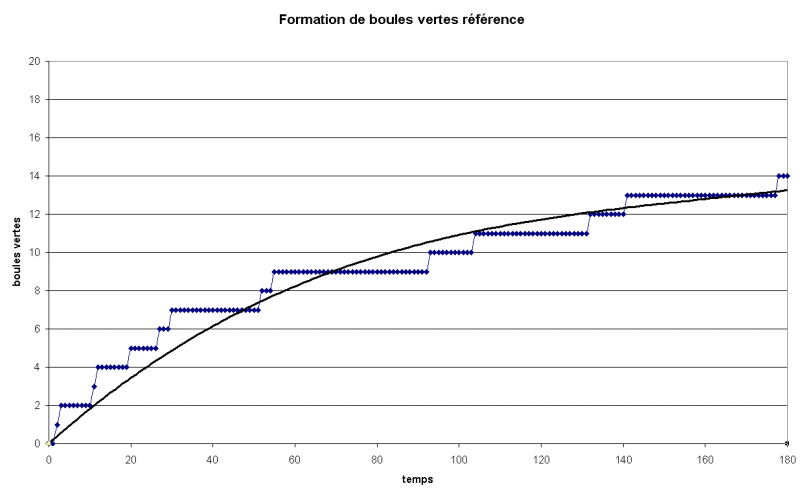
Une courbe de tendance à
été réalisée (polynomiale ordre 3
ou 2 sur excel passant par 0)
Détermination du temps
de demi-réaction :
La quantité maximale de boules vertes pouvant être
formées est égale à xmax = 20
Alors le temps de demi-réaction, est la date à
laquelle on a 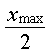 =
10 =
10
On trouve graphiquement t1/2 = 82 s (environ)
1. Augmentation de la température
(augmentation de la probabilité de chocs efficaces).
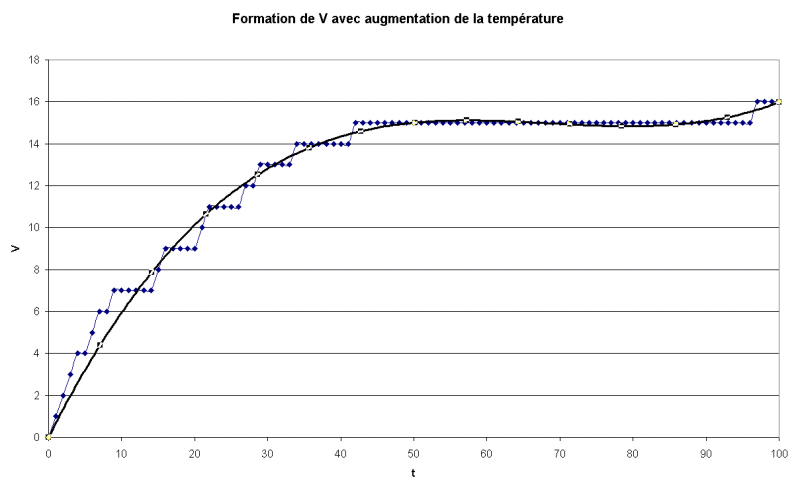
Pour 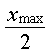 =
10, on trouve graphiquement t1/2 = 20 s (environ) =
10, on trouve graphiquement t1/2 = 20 s (environ)
2. Diminution de la concentration
par dilution :
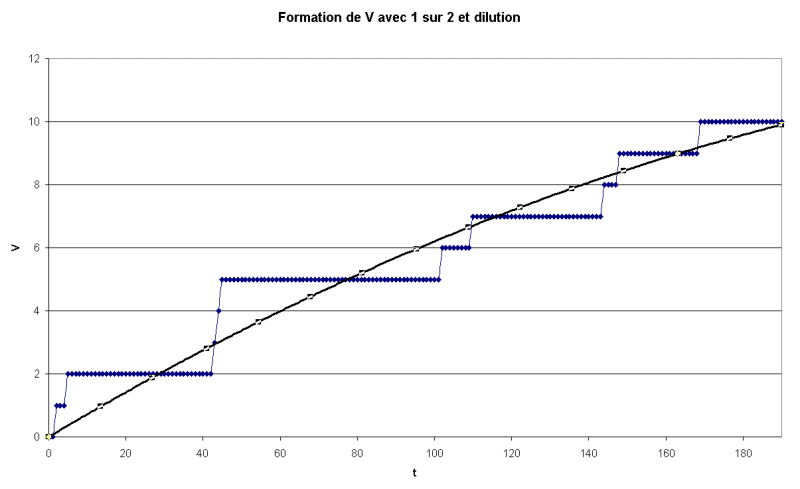
Pour 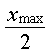 =
10, on trouve graphiquement t1/2 = 190 s (environ) =
10, on trouve graphiquement t1/2 = 190 s (environ)
Conclusion :
t1/2 ( température élevée)
< t1/2 ( température ambiante) < t1/2
( température ambiante + dilution)
- L'augmentation de température
augmente la vitesse par augmentation de la probabilité
de chocs efficaces.
- La diminution de la concentration (dilution) diminue la vitesse
par diminution de la probabilité de chocs efficaces.
III. Aspect énergétique
d'une transformation.
(limite externe du programme).
Pour qu'une transformation
se produise, il faut que le entités chimiques reçoivent
suffisamment d'énergie pour rompre les liaisons chimiques.
Tous les chocs ne sont pas efficaces car les molécules
ne possèdent pas assez d'énergie.
La somme de leurs énergies cinétiques doit être
supérieure ou égale à l'énergie nécessaire
pour rompre les liaisons, sinon elles sont déviées.
Voir livre pages 80 à
90 pour approfondissement.
|