|
  Imprimer
Imprimer
Parce qu'il le vaut
bien ! (10 points).
MONSIEUR MORIN qui est soucieux
de la qualité de sa chevelure, souhaite se laver les cheveux
avec un savon liquide doux.
Nous allons suivre le protocole complet du lavage de ses cheveux.
1. MONSIEUR MORIN n'utilise
pas un shampoing ordinaire, il le fabrique.
MONSIEUR MORIN fabrique ses
propres savons liquides afin d'être sûr que ces cheveux
soient bien traité.
Pour cela, il prépare un savon à partir d'huile
d'olive et d'une solution d'ions hydroxyde.
L'huile d'olive contient des corps gras constitué essentiellement
à partir d'acide oléique et d'acide palmitique.
Acide oléique :
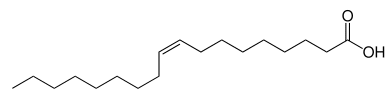
Acide palmitique :

1.1. Donner les formules brutes
des acides oléique et palmitique.
1.2. Ecrire l'équation associée à la transformation
entre ces acides et le glycérol (on notera R- les groupements
alkyles CH3-CH2-….).
1.3. A quelle famille appartiennent les produits obtenus ?
1.4. Donner les caractéristiques de cette transformation.
1.5. MONSIEUR MORIN souhaite maintenant fabriquer un savon mou
(liquide) à partir d'huile d'olive avec une solution basique
concentrée, à chaud.
Doit-il utiliser de la soude (NaOH) ou de la potasse (KOH) ?
1.6. Donner les caractéristiques de cette transformation.
1.7. Quel nom donne-t-on cette transformation ?
1.8. Etude expérimentale de la réaction entre l'oléine
(triester formé à partir de l'acide oléique)
et les ions HO-.
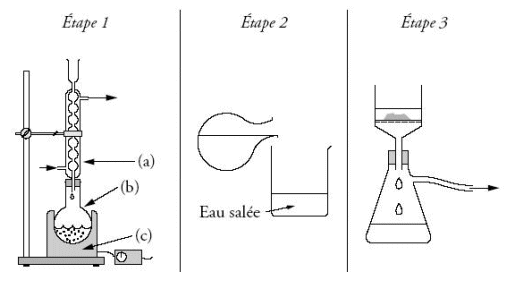
Étape 1 : on chauffe pendant trente minutes un mélange
de :
- 2,0 X 10-2 mol d'oléine
- 5,0 X10-2 mol d'hydroxyde de potassium.
· 2 mL d'éthanol et quelques grains de pierre ponce.
Étape 2 : on laisse refroidir le mélange quelques
minutes puis on le transvase dans un becher contenant une solution
aqueuse concentrée de chlorure de sodium.
Étape 3 : le précipité obtenu est filtré,
rincé à l'eau salée, séché
puis pesé. La masse expérimentale obtenue est mexp
= 10,5 g.
Données :
· Formule de l'oléine
:
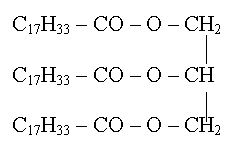

1.8.1. A propos du mode opératoire.
a) Préciser le nom de
l'opération réalisée aux étapes 1
et 3.
b) Justifier, en vous aidant du tableau des solubilités,
l'emploi de l'eau salée dans l'étape 2.
c) Nommer les éléments (a), (b), (c), du montage
utilisé dans l'étape 1.
Quel est le rôle de l'élément (a) ?
d) Quel est le rôle de la pierre ponce ?
e) Pourquoi opère-t-on à chaud ?
1.8.2. Étude quantitative
a) Écrire l'équation
de la réaction modélisant la transformation qui
a lieu dans l'étape 1 en utilisant les formules semi-développées.
Nommer les produits obtenus (1 et 2).
b) Compléter le tableau d'avancement suivant :
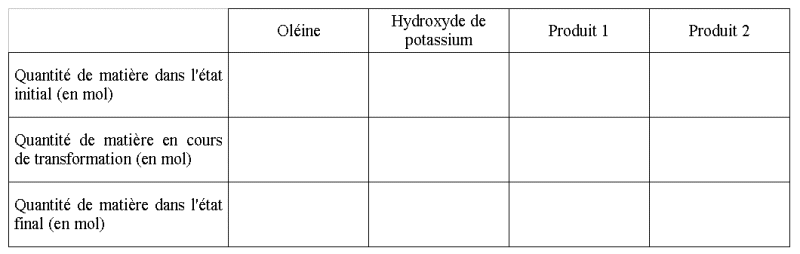
En déduire le réactif
limitant.
c) Définir puis calculer
le rendement de cette transformation.
1.8.3. Etude cinétique.
On mesure l'avancement de la
réaction en fonction du temps.
On obtient le graphe suivant :
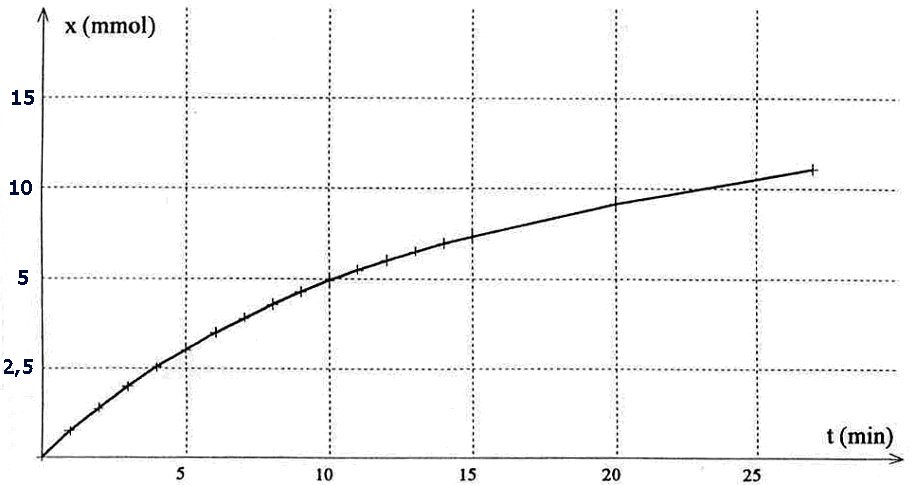
1.8.3.1. Donner l'expression
de la vitesse volumique de réaction en précisant
les unités.
1.8.3.2. Expliquer la méthode
permettant d'évaluer graphiquement cette vitesse à
un instant donné.
1.8.3.3. Comment évolue
cette vitesse au cours de la transformation chimique ? Quel est
le facteur cinétique mis en jeu ?
1.8.3.4. Définir le
temps de demi-réaction. Trouver sa valeur à partir
du graphe ci-dessus et du tableau obtenu à la question
1.8.2.
1.8.3.5. On reproduit la même
expérience à une température plus basse
égale à 20°C.
Tracer, sur le graphe ci-dessus, l'allure de la courbe obtenue.
On justifiera le tracé.
2. Monsieur Morin n'utilise pas l'eau du robinet pour se laver
les cheveux, il utilise une eau de source en bouteille !
Monsieur Morin choisit avec
soin l'eau pour se laver les cheveux.
Il a le choix entre ces différentes eaux :




1. Qu'appelle-t-on une eau
dure ?
2. Quelle eau est doit-il choisir afin que la lavage de ces cheveux
soit efficace ? Pourquoi ?
3. Monsieur Morin utilise
un tonifiant pour ses cheveux : le vinaigre !
Monsieur Morin veut se frictionner
les cheveux avec un peu de vinaigre, mais il vérifie toujours
la qualité de celui-ci et en particulier son pH.
Le vinaigre est une solution aqueuse d'acide acétique
de formule CH3COOH.
On mesure le pH d'une solution diluée.
Le pH vaut 3,40 et la concentration de la solution diluée
est 1,00 x 10-2 mol.L-1
Le volume utilisé de solution diluée est égale
à V = 1,0 L
Données :
- Pour le couple acido-basique
CH3COOH / CH3COO- , pKa = 4,75
- On admet que la conductivité s d'une solution ionique
est fonction des concentrations molaires [M+] et [X-] des ions
M+ et X- et de leurs conductivités molaires ioniques l(M+)
et l(X-) selon la loi :
s
= l(M-+)
. [M+] + l(X-) . [X-].
Les unités sont celles du système SI : conductivité
en S.m-1 ; concentrations molaires en mol.m-3 et conductivité
molaires ioniques en S.m².mol-1 .
- Valeurs des conductivités
molaires ioniques :
l(H3O+)
= 35,0 .10-3 S.m².mol-1 ; l(CH3COO-) = 4,09
.10-3 S.m².mol-1
2.a - Ecrire l'équation
modélisant la réaction chimique entre l'acide acétique
et l'eau.
2.b - Donner l'expression littérale de la constante d'équilibre
associée à cette réaction.
Calculer sa valeur numérique.
2.c - Etablir le tableau d'avancement
de la réaction. Calculer le taux d'avancement de celle-ci.
Conclure.
2.d - On mesure la conductivité de la solution diluée
d'acide acétique et on trouve s = 15,5 X 10-3 S.m-1.
Retrouver la valeur de son pH.
Conclusion : Monsieur MORIN
peut sortir avec ses cheveux propres et songer à la citation
de WALTER CAMPOS DE CARVALHO :
Chaque fil de mes
cheveux est une vérité différente.
  Imprimer Imprimer
I. Parce qu'il le
vaut bien ! (10 points). Correction.
1. MONSIEUR MORIN n'utilise
pas un shampoing ordinaire, il le fabrique.
1.1. Formules brutes des acides oléique et palmitique
: C18H34O2et C16H32O2
1.2. Equation associée à la transformation entre
ces acides et le glycérol :

1.3. On obtient un triseter
et de l'eau.
1.4. Cette transformation est lente et limitée.
1.5. Il doit utiliser de la potasse pour obtenir un savon mou.
1.6. Cette transformation est lente (plus rapide toutefois que
l'hydrolyse d'un ester par l'eau) et totale.
1.7. Il s'agit d'une saponification.
1.8.1.
a) Montage à reflux et filtration sur Büchner.
b) L'eau salée permet de faire précipité
le savon obtenu car il est peu soluble dans l'eau salée.
c) (a) : Réfrigérant à boules ; (b) : ballon
; (c) : chauffe-ballon.
l'élément (a) sert à recondenser les vapeurs
et ainsi d'éviter des pertes de produits ou de réactifs.
d) La pierre ponce sert à réguler l'ébullition.
e) On opère à chaud pour accélérer
la réaction.
1.8.2. Étude quantitative
a) Equation :
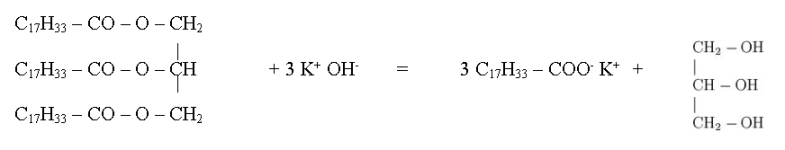
Produits obtenus : (1) : oléate
de potassium ; (2) : glycérol
b)

5,0 x 10-2 - 3xmax
= 0 alors xmax = 1,7 x 10-2 mol
Le réactif limitant est l'hydroyde de potassium
c) Le rendement de la réaction
est égale à
Calculons xf = 3,4 x 10-2 mol

1.8.3. Etude cinétique.
1.8.3.1. Vitesse volumique
de réaction : v s'exprime dans cet exercice en mmol.min-1.L-1
1.8.3.2. Méthode graphique
: on détermine la valeur du coefficient directeur que
l'on divise par le volume.
1.8.3.3. La vitesse diminue
au cours de la transformation chimique. Le facteur cinétique
mis en jeu est la concentration des réactifs qui diminue
au cours du temps.
1.8.3.4. Le temps de demi-réaction
est la durée nécessaire pour atteindre xmax
/ 2
Dans la question 1.8.2 on a trouvé xmax
= 1,7 x 10-2 mol soit 17 mmol.
On détermine la date correspondant à soit 8,5 mmol,
et on trouve t1/2 = 20 min.
1.8.3.5. A plus basse température, on obtient une courbe
traduisant une évolution plus
lente de la tranbsformation, mais dont l'état final n'est
pas modifié.

2. Monsieur Morin n'utilise
pas l'eau du robinet pour se laver les cheveux, il utilise une
eau de source en bouteille !
1. Une eau dure est une eau
riche en ion calcium Ca2+ et magnésium Mg2+
2. Il doit choisir une eau douce (eau d'Evian) car l'eau d'Hépar
est très riche en ions calcium Ca2+ et magnésium
Mg2+ qui forment des liaisons entre les molécules
de savons et diminuent ainsi leurs pouvoir détergent.
3. Monsieur Morin utilise
un tonifiant pour ses cheveux : le vinaigre !
3.a - Equation CH3COOH
+ H2O = CH3COO-+ H3O+
3.b - 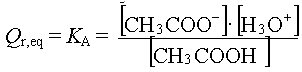 = 10-pKA = 10-4,75=
1,78 x 10-5 = 10-pKA = 10-4,75=
1,78 x 10-5
3.c - Tableau d'avancement
de la réaction :


La transformation de l'acide éthanoïque avec l'eau
n'est pas totale, elle est limitée.
3.d - s = l(H3O+).[H3O+]
+ l(CH3COO-).[CH3COO-]
On a [H3O+]
= [CH3COO-] alors s = (l(H3O+) + l(CH3COO-)).[H3O+]
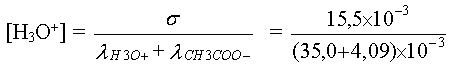
[H3O+]
= 3,97 x 10-1 mol.m-3 = 3,97 x 10-4mol.L-1
pH = - log [H3O+] = 3,40
|