|
  Imprimer Imprimer
Un système
chimique évolue spontanément vers l'état
d'équilibre
I. Expression du quotient
de réaction dans le cas de réactions acido-basiques
et d'oxydoréduction.
1. Expression
générale pour la réaction aA(aq) + bB(aq)
= cC(aq) + dD(aq)
Nous avons vu dans le chapitre
précédent que 
On s'intéressera en
particulier au quotient de réaction dans l'état
initial, noté Qr,i
, qui tient compte des
concentrations initiales apportées par les espèces
dissoutes avant la réaction.
2. Calcul
de Qr,i.
2.1. Cas d'une réaction
acido-basique.
On réalise le mélange
de quatre espèces chimiques différentes décrit
dans le tableau ci-dessous :

La transformation étudiée
est : 

Questions discussion réponses
:
1. Ecrire l'équation
de la dissolution du méthanoate de sodium dans l'eau.
2. Ecrire l'équation de la dissolution du chlorure d'ammonium
dans l'eau.
3. Déterminer les quantités de matière de
chaque espèce chimique introduite.
4. En déduire les concentrations de chaque espèce
chimique dans le mélange.
5. Ecrire l'expression du quotient de réaction dans les
conditions initiales.
Les ions Na+ et Cl- sont spectateurs.
6. Calculer sa valeur.
Réponse :
1. 
2. 
3. Avec n = CV on a :

4. Calculs
des concentrations.

Les concentrations sont calculées à partir du volume
total du mélange Vtotal
= 800,0 mL = 0,800 L
Avec 

5. 
6. 
2.2. Cas d'une réaction
d'oxydo-réduction.
On veut établir l'expression
de Qr,i pour la réaction suivante :

On note V le volume
total du mélange et nFe2+ , nFe3+ , nI- et nI2 les
quantités de matières introduites initialement.

Question discussion réponse
:
Exprimer en fonction de V
, nFe2+ , nFe3+ , nI- et nI2 le quotient
de réaction dans l'état initial.
Réponse :
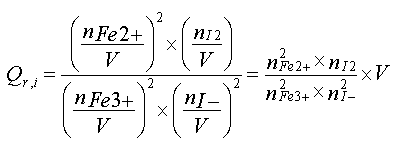
II. Critère d'évolution spontanée : étude
du rapport 
1. Cas d'une
réaction acido-basique.
Réaction étudiée
: 
Les espèces chimiques
présentes sont :
- l'acide méthanoïque
V1
- le méthanoate de sodium V2
- l'acide éthanoïque V3
- l'éthanoate de sodium V4
Le volume total est V
= V1 + V2 + V3 + V4
pKA (HCOOH / HCOO-
) = 3,8
pKA (CH3COOH / CH3COO-
) = 4,8
Toutes les solutions ont la
même concentrations c = 1,0 x 10-1 mol.L-1
On veut déterminer la
valeur du rapport  pour différentes conditions expérimentales.
pour différentes conditions expérimentales.
Dans un premier temps, on calcul K :

Dans un deuxième temps, on détermine l'expression
de Qr,i :

Dans un troisième temps, on étudie différents
cas proposés dans le tableau ci-dessous :

Le sens d'évolution
spontané d'un système chimique est celui au cours
duquel 
Selon la valeur de :
- le sens est direct  < 1 < 1 
- pas d'évolution  = 1 = 1 
- le sens est inverse  > 1 > 1 

Question discussion réponse
:
- Déterminer Qr,i
, K et 
- Déterminer le sens d'évolution spontanée
de la transformation dans les différents cas.
- Conclusion :
- Si  < 1 le sens spontané est le sens …………….
< 1 le sens spontané est le sens …………….
- Si  = 1 …………………………………………..
= 1 …………………………………………..
- Si  > 1 le sens spontané est le sens …………….
> 1 le sens spontané est le sens …………….
Réponse :


- Si  < 1 le sens spontané est le sens direct
< 1 le sens spontané est le sens direct
- Si  = 1 il n'y a pas d'évolution du système
= 1 il n'y a pas d'évolution du système
- Si  > 1 le sens spontané est le sens inverse
> 1 le sens spontané est le sens inverse
2. Cas des
réactions d'oxydoréduction.
Théoriquement, les transformations
mettant en jeu des réactions d'oxydoréduction peuvent
avoir lieu dans les deux sens.
En pratique, est-ce le cas
?

Expériences de cours
:
Expérience n° 1
:
On introduit du fer en poudre
dans un bécher contenant une solution aqueuse de sulfate
de cuivre II de concentration 1 mol.L-1 .
On obtient le résultat
suivant :

Il se forme un précipité
vert lors du test à la soude réalisé sur
le contenu du bécher au bout de quelques minutes.
L'équation associé
à cette transformation est : 
Expérience n°2 :
On introduit du cuivre en tournure
dans un bécher contenant une solution aqueuse de sulfate
de fer de concentration 1 mol.L-1.
On obtient le résultat
suivant :

Il se forme un précipité
vert lors du test à la soude réalisé sur
le contenu du bécher au bout de quelques minutes. Il n'y
a pas de précipité précipité bleu
caractéristique des ions cuivre II.
Au bout d'une durée
plus longue, il n'apparaît toujours pas de précipité
bleu.

Question discussion réponse
:
Dans des tables de données,
la valeur de la constante d'équilibre K de la réaction
d'oxydo-réduction
 est
: K = 2,8 x 1026 est
: K = 2,8 x 1026
En calculant , montrer que
le sens direct de cette transformation est très privilégié.
Réponse :
On détermine la valeur
de Qr,i  (on
ne tient pas compte des espèces solides) (on
ne tient pas compte des espèces solides)
Alors  =
0 < 1 la réaction a lieu dans le sens direct. =
0 < 1 la réaction a lieu dans le sens direct.
De plus Qr,i
est très petit devant K, alors la réaction
n'a lieu que dans un sens.
  Imprimer Imprimer
Les piles,
dispositifs mettant en jeu des transformations spontanées
permettant de récupérer de l'énergie
I. Peut-on
prévoir l'évolution d'une pile ?
1. Mise
en évidence expérimentale du sens spontané
de l'évolution du système.
On s'intéresse
à la transformation suivante : 

Question discussion
réponse :
Proposer une
expérience permettant de mettre en évidence le
sens spontané de l'évolution du système
?
Réponse
:
Comme dans
le chapitre précédent, on effectue deux expériences
:
|
Expérience
n° 1 |
Expérience
n° 2 |
 |
 |
|
Tournure
de cuivre + solution de sulfate de zinc |
Zinc
en poudre + solution de sulfate de cuivre |
Les résultats expérimentaux sont les suivants :
|
Expérience
n° 1 |
Expérience
n° 2 |
 |
 |
|
Pas
de réaction |
Apparition
de métal cuivre et décoloration de la solution
(apparition d'ions Zn2+) |
2. Interprétation.
Il y a eu transfert
d'électrons du zinc Zn vers l'ion cuivre Cu2+
On peut donc prévoir le sens spontanée du système
: les électrons sont transférés de l'espèce
chimique la plus réductrice vers celle la plus oxydante.
La constante d'équilibre est évidemment très
élevée K = 2,0 x 1037
Les deux demi-équations
s'écrivent :

II. Peut-on réaliser ce transfert électronique
sans qu'il y ait contact direct entre l'oxydant et le réducteur
?
Cette partie
est également vue en TP.
1. Réalisation
d'une pile.

- Dans une
solution de sulfate de zinc, on plonge une électrode de
zinc.
- Dans une solution de sulfate de cuivre, on plonge une électrode
de cuivre.
- Un pont salin contenant des ions K+ et NO3-assure la conduction électrique tout en
maintenant l'électroneutralité des solutions électrolytiques.
2. Détermination
expérimentale de la polarité.

On relie les
deux électrodes par un circuit comprenant une résistance
et un ampèremètre.

Question discussion
réponse :
- A partir
du sens spontané de la transformation  ,
en déduire le sens des électrons dans le circuit. ,
en déduire le sens des électrons dans le circuit.
- En déduire le sens conventionnel du courant i dans le
circuit.
- Indiquer les pôles positif et négatif des électrodes.
Réponse
:
- Le sens spontanée
est Zn (s) = 2 e- + Zn2+ (aq), donc l'électrode de zinc libèrent
des électrons et l'électrode de cuivre reçoit
des électrons Cu2+(aq) + 2 e- = Cu (s).
Les électrons vont de l'électrode de zinc vers
l'électrode de cuivre.
- Le sens conventionnel du courant est opposé aux mouvements
de électrons. Le courant i va de l'électrode
de cuivre vers l'électrode de zinc.
- Le sens conventionnel du courant va du pôle positif vers
le pôle négatif à l'extérieur de la
pile, alors l'électrode de cuivre constitue le pôle
+ et l'électrode de zinc le pôle -.
3. Les
réactions aux électrodes et réaction globale.

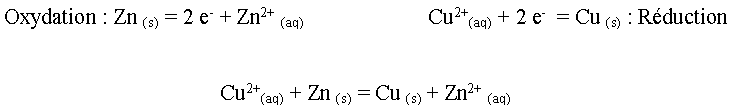
4. Mouvements
des porteurs de charges.

Les électrons
ne savent pas nager !
C'est à dire que les porteurs de charges dans les solutions
électrolytiques sont les ions.

Question discussion
réponse :
Les réactions
aux électrodes entraînent un déséquilibre
de la neutralité dans chaque compartiment.
Indiquez comment vont se déplacer les ions K+ et NO3- du pont salin.
Réponse
:

Lors de la
réaction d'oxydation Zn (s)
= 2 e- + Zn2+ (aq), la quantité
d'ions positifs Zn2+ augmente. Pour assurer
l'électroneutralité, les ions NO3- se déplacent
vers le compartiment de gauche.
Lors de la
réaction de réduction Cu2+(aq)
+ 2 e- = Cu (s), la quantité d'ions positifs
Cu2+ diminue.
Pour assurer l'électroneutralité, les ions K+ se déplacent vers le compartiment
de droite.
5. Représentation
formelle d'une pile.
La pile précédente
a été orientée judicieusement afin d'avoir
la borne négative à gauche et la borne positive
à droite.
La représentation formelle de la pile est :

Méthode
:
- le signe
moins à gauche, le signe plus à droite
- les métaux solides aux extrémités
- les ions métalliques au centre
- le pont salin est représenté au centre par les
deux traits verticaux ( || )
- un trait vertical indique un changement de phase (solide |
liquide)
III. La
pile un système hors équilibre au cours de son
fonctionnement en générateur.
Cette partie
est également vue en TP.
1. Force
électromotrice et résistance interne d'une pile.
La tension
délivrée par la pile dépend de plusieurs
paramètres :
Elle dépend
:
- de sa force
électromotrice E (tension à vide) qui dépend
elle-même :
o du couple oxydant / réducteur utilisé
o des concentrations des solutions ioniques constituants le couple
o du temps d'utilisation
- de sa résistance interne r
La tension
aux bornes d'une pile a pour expression : UPN = E - rI
E est la tension à vide (i = 0) ou f.é.m
(force électromotrice)
2. Pile
en fonctionnement et pile usée.
On considère
la pile dont l'équation globale est : 
- Conditions
initiales :
Si dans les
conditions initiales, on dispose par exemple de concentrations
en ions Zn2+ et Cu2+ égales.
[Zn2+] = [Cu2+]
Alors, le quotient de réaction dans les conditions initiales
est égal à 
- Au cours
du temps :
La concentration [Zn2+] augmente.
La concentration [Cu2+] diminue.
Alors Qr,i augmente et tend vers K.
- La pile est
usée quand :
- Le système
atteint son équilibre Qr = K
- Quand l'un
des réactifs disparaît. (dans ce cas, le cuivre).
IV. Quelle
est la quantité maximale qu'une pile peut débitée
pendant une durée Dt ?
1. Capacité
en charge Qmax
La pile a fonctionné
pendant une durée maximale Dtmax
La quantité d'électricité maximale débitée
est Qmax = I x Dtmax
Qmax est appelé capacité
en charge. Elle s'exprime en A.h.
2. De quoi
dépend Qmax ?
- La quantité
(mol) d'électrons échangée n
- Le nombre d'électrons échangés est alors
n x NA
- La charge de n x NA
électron est n x NA x |e|
|e| étant la valeur absolue de la charge élémentaire
Alors Qmax = n x NA x |e|
Remarque :
on appelle Faraday le produit NA x |e| = 6,02 x 1023 x 1,6 x 10-19 = 96 500 C
1 F = 96 500 C

Attention :
Si on utilise le Faraday qui s'exprime dans l'unité internationale
(Coulomb), il faut convertir les heures en secondes (s).
(1 h = 3 600 s)

Question discussion
réponse :
Une pile alcaline
de capacité de charge Qmax = 8 A.h se décharge complètement
en 30 h. (1 F = 96 500 C)
1. Quelle intensité
peut-elle débitée ?
2. Quelle quantité d'électron ont circulé
?
3. Combien d'électron ont circulé ?
Réponses
:
1. 
2. 
3. Le nombre
d'électrons ayant circulé est égal à
n.NA = 0,30 x 6,02 x 1023 = 1,81 x 1023 e-
  Imprimer Imprimer
Exemples de transformations
forcées
I. Mise en évidence
de la possibilité de changer le sens d'évolution
d'un système.
1. Transformations
spontanée de la pile cuivre-argent.
On réalise la pile suivante
:


Question discussion réponse
:
- Ecrire la représentation
symbolique de cette pile.
- Indiquer le sens conventionnel du courant électrique
i.
- Indiquer le sens de déplacement des électrons.
- Ecrire les demi-équations aux électrodes et l'équation
globale.
Réponse :
Représentation symbolique
:

Sens du courant et des électrons

Demi-équations et équation
globale :
Oxydation : Cu (s)
= Cu2+(aq) + 2 e-
Réduction : Ag+(aq) + e- = Ag (s)
Equation globale : Cu (s) + 2 Ag+(aq) =
Cu2+(aq) + 2 Ag (s)
Quand la pile est usée,
le système est à l'équilibre.
La pile ne débite plus.
La f.é.m est nulle. E = 0.
Comment faire pour recharger
cette pile ?
2. Peut-on
forcer l'évolution du système pour qu'il reforme
des ions argent ?
Cette partie est vue également
en TP.
Afin de forcer le système
à évoluer dans le sens inverse au sens spontanée,
il faut un apport d'énergie.
On introduit un générateur
dans le circuit.


Question discussion réponse
:
Où la borne positive
du générateur doit-elle être placée
?
 ?
?
Réponse :
L'objectif est de reformer
des ions Ag+, dont la concentration a fortement diminuée.
Il faut forcer la réaction de formation d'ions Ag+
Ag (s) = Ag+(aq) +
e- (oxydation)
Les électrons formés sont attirés par la
borne positive du générateur.
La réaction dans l'autre
compartiment sera alors :
Cu2+(aq)
+ 2 e- = Cu (s) (reduction)
Les électrons proviennent de la borne négative
du générateur

Si on retire le générateur
et on laisse la pile débitée, on observe que la
transformation s'effectue à nouveau dans le sens spontanée.
Anode Cathode Cathode
La pile usée a été
rechargée.
On a réalisé
un accumulateur.
Ce phénomène
est appelé électrolyse.
II. L'électrolyse.
1. Définition.
L'électrolyse est une
transformation chimique forcée, due à la circulation
d'un courant débité par un générateur.
La transformation a lieu dans le sens inverse au sens spontanée.
2. Réactions
aux électrodes.
L'électrode à
laquelle se produit la réduction est la cathode
L'électrode à laquelle se produit l'oxydation est
l'anode
Anode (électrode où
arrive le courant i)
Cathode (électrode d'où part le courant i)
 Astuces pour se rappeler facilement quelle électrode est
l'anode :
Astuces pour se rappeler facilement quelle électrode est
l'anode :
- L'oxydation est anodique
Les deux mots commencent par une voyelle : a et o
- La réduction est cathodique Les deux mots
commencent par une consonne : r et c
ou encore :
l'anode est l'électrode
où arrive le courant i. Le nom et le verbe commencent
par un a
 Ca
vaut ce que ça vaut ! A vous de juger ! Ca
vaut ce que ça vaut ! A vous de juger !
La quantité d'électrons
échangés lors d'une électrolyse est la même
au niveau des deux électrodes.
3. Application
de l'électrolyse : L'argenture
Source :
Le bain d'argenture dans lequel
les pièces sont immergées contient, en dissolution,
des sels d'argent. Il est soumis au passage d'un courant électrique
de faible intensité par l'intermédiaire de deux
électrodes : l'anode (plaques d'argent pur) et la cathode,
constituées par les pièces à argenter.


Question discussion réponse
:
- Faire un schéma simplifié
du dispositif nécessaire afin de réaliser l'argenture.
Vous disposez d'une cuve, d'une fourchette à argenter,
d'une électrode d'argent et
d'un générateur de tension continue.
- Indiquer le sens du courant et le sens de déplacement
de l'ensemble des porteurs
de charges.
- Ecrire les demi-équations aux électrodes.
Réponse :
Schéma du dispositif
et mouvements des porteurs de charges

A l'anode (électrode
où arrive le courant i) ,
l'argent métallique Ag subit une oxydation
(oxydation anodique)
Ag (s) = Ag+(aq) +
e-
A la cathode (fourchette),
l'ion argent Ag+
subit une réduction (réduction cathodique)
Ag+(aq)
+ e- = Ag (s)
|